



中國非公立醫療機構協會是由依法獲得醫療機構執業許可的非公立醫療機構、相關企事業單位和社會團體等有關組織和個人自愿結成的全國性、行業性、非營利性社會組織。更多>>
《藥品生產監督管理辦法》今日起施行 | 重點內容解讀及合規建議
前言
《藥品生產監督管理辦法》(下稱“辦法”)于2020年1月22日發布,今日正式施行。新版《辦法》相較于2017的修正版,其框架從7章變為6章,內容從60個條款、約0.81萬字增至81個條款、約1.87萬字。本文結合《藥品管理法》對新版《辦法》的重點內容進行解讀,并結合實務給出簡要合規建議。
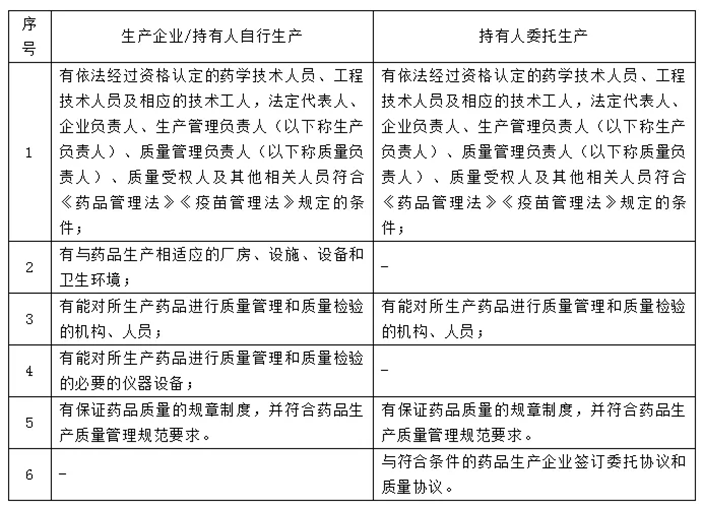
對比可以發現,對于委托生產的MAH,《辦法》并不要求其具備生產的硬件,如設備設施以及廠房等,而是對持有人的“軟實力”提出要求,持有人應當具備管理能力。這樣的設計與《藥品管理法》中持有人對藥品從研發、生產到使用全過程負責的要求相契合,事實上持有人只有具備專業人員和配套的規范制度才能真正管控藥品的質量、保證安全性。否則,不具備履責能力的持有人如何承擔的起保障藥品全生命周期的責任與義務。
2、取消GMP認證,改為持續合規檢查
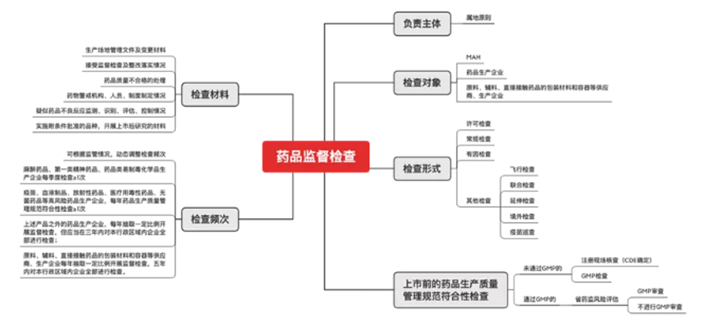
根據國家藥監局公告,自2019年12月1日起,取消藥品GMP認證,不再受理GMP認證申請,不再發放藥品GMP證書。雖然GMP認證取消,但藥品生產及監督仍應遵循藥品生產質量管理規范。根據《藥品管理法》的規定,藥品監督管理部門對企業遵守規范情況進行持續監督、隨時檢查。《辦法》進一步細化、明確了檢查要求,通過上市前、許可檢查、上市后檢查等全階段、貫穿整個藥品生命周期的動態檢查來監督企業符合規范的情況。通過常規檢查、有因檢查、飛行檢查、延伸檢查等形式靈活執行檢查工作。GMP檢查由“點”合規檢查變為持續合規檢查,實際上增大了檢查力度,對生產企業及持有人提出了更高的要求。
3、細化、落實《藥品管理法》最嚴厲的處罰
根據《辦法》規定,藥品生產企業、持有人未配備專門質量負責人、質量受權人、質量體系不能運行、質控數據不真實、對已有風險未采取風控措施;輔料、直接接觸藥品的包裝材料和容器的生產企業及供應商未遵守國家藥品監督管理局制定的質量管理規范等相關要求的六種情形,按《藥品管理法》第一百二十六條規定可處以罰款、停業整頓、吊銷藥品批準證書、十年直至終身禁止從事藥品生產經營等處罰。
同時增加企業未按規定辦理變更登記,未對人員進行健康檢查、建立健康檔案,未進行短缺藥品停產報告,處1-3萬元罰款的處罰條款。
4、跨省監管、信息互通
對于持有人和受托藥品生產企業不在同一省的,由持有人所在地省級藥品監管部門負責對藥品上市許可持有人的監督管理,受托藥品生產企業所在地省級藥品監管部門負責對受托藥品生產企業的監督管理。
省級藥品監督管理部門加強監督檢查信息互相通報,及時更新藥品安全信用檔案。
5、建立藥品追溯制度、年報制度
MAH和生產企業建立藥品追溯制度,及時準確記錄、保存藥品追溯數據并向藥品追溯協同服務平臺提供信息。
MAH應當建立年度報告制度,每年將藥品生產銷售、上市后研究、風險管理等情況按照規定向省、自治區、直轄市人民政府藥品監督管理部門報告。
1.《辦法》實施后,部分問題仍需配套文件、政策予以明確。如:
(1)《辦法》規定了境外持有人應委托境內企業履行持有人義務,那么該受托人的地位應該相當于境內MAH,理論上該受托人也應當取得《生產許可證》。對于雙方之間的委托在執行層面上應如何落實,受托人資格、委托協議格式、范圍是否有專門要求,委托行為是否需備案等問題還需明確。
(2)《辦法》提出場地管理文件的概念,并規定對藥品生產場地進行統一編碼。對于如何編碼、場地管理文件包括內容、編寫要求等仍需另行制定。
(3)《辦法》規定藥品委托生產按照藥品委托生產質量協議指南要求履行,目前指南的征求意見稿已完成公眾征求意見階段,待正式文件出臺。
2、合規建議
《藥品管理法》及《辦法》的出臺,對MAH和藥品生產企業都提出了更高的合規要求。
對于委托生產的MAH而言,作為藥品全生命周期的管理者和責任人,在藥品的不同階段都涉及與其他企業(如CRO、CMO、受托生產企業、銷售企業、運輸企業)的協同合作,如何通過協議正確地分配權責,有效地落實監管工作,保證各環節的合法合規以及確保有效的追償至關重要。而在內部管理上,應建立健全的質量管理體系、物料供應商管理制度、藥品指控制度、上市放行制度、藥品追溯制度、年報制度、藥物警戒制度、召回制度、文件管理制度等管理規范。
對于藥品生產企業,持續的GMP合規要求企業加強日常監管、人員培訓,動態的進行自我評價以及改進。
